Como recuperar materiais de baterias de celular usadas?
Item
Título para divulgação do texto
Como recuperar materiais de baterias de celular usadas?
Título original da pesquisa
Método hidrometalúrgico para reciclagem de metais terras raras, cobalto, níquel, ferro e manganês de eletrodos negativos de baterias exauridas de Ni-MH de telefone celular
Imagem de capa
Revisão de texto
Autores do texto original
Fonte(s) Financiadora(s)
Resumo
Os pesquisadores desenvolveram um método para recuperar elementos químicos importantes presentes nas baterias de Ni-MH, como níquel, cobalto, ferro e metais terras raras.
Tipo
Artigo de periódico
O que é a pesquisa?
O descarte de baterias é uma preocupação ambiental, pois metais tóxicos e pesados, que fazem parte de sua composição, podem contaminar solo, plantas e animais. Nos últimos anos, baterias de Ni-MH que eram usadas em telefones celulares e computadores portáteis vem sendo gradativamente substituídas por baterias de íons-lítio, pois possuem maior capacidade de armazenamento e menor perda de energia. Devido a essa substituição, uma grande quantidade de baterias usadas de Ni-MH foi acumulada, necessitando maneiras apropriadas de descarte ou de reutilização.
Nesse sentido, pesquisa realizada em conjunto pelo Departamento de Química da Universidade Federal do Espírito Santo e pelo Instituto Federal do Espírito Santo (campus Aracruz), desenvolveu um método para recuperar elementos químicos importantes presentes nas baterias de Ni-MH, como níquel, cobalto, ferro e metais terras raras. Dois desses elementos são recuperados na forma de compostos, hidróxidos de níquel e de cobalto, que foram usados na síntese de óxido de lítio-cobalto, matéria-prima para as modernas baterias de íon-lítio. Esse trabalho foi publicado no periódico “Química Nova” da Sociedade Brasileira de Química.
Nesse sentido, pesquisa realizada em conjunto pelo Departamento de Química da Universidade Federal do Espírito Santo e pelo Instituto Federal do Espírito Santo (campus Aracruz), desenvolveu um método para recuperar elementos químicos importantes presentes nas baterias de Ni-MH, como níquel, cobalto, ferro e metais terras raras. Dois desses elementos são recuperados na forma de compostos, hidróxidos de níquel e de cobalto, que foram usados na síntese de óxido de lítio-cobalto, matéria-prima para as modernas baterias de íon-lítio. Esse trabalho foi publicado no periódico “Química Nova” da Sociedade Brasileira de Química.
Como é feita a pesquisa?
A pesquisa consistiu em uma sequência de reações químicas controladas para a extração gradual dos elementos químicos das baterias de Ni-MH. As baterias foram desmontadas e suas partes constituintes, incluindo eletrodos positivos e negativos, foram separadas.
Em seguida, os cientistas reuniram os eletrodos negativos (MH) das baterias, dissolveram-nos em ácido, filtraram a solução líquida resultante e adicionaram a ela soda cáustica (hidróxido de sódio). Isso fez com que os metais terras raras lantânio (La) e cério (Ce), originalmente presentes na liga metálica, se agregassem e precipitassem, formando um novo sólido. Esse sólido foi separado do resto da solução aquosa e suas características moleculares foram avaliadas com técnicas de espectroscopia.
A composição química do sólido obtido foi determinada com difração de raios X, que confirmou a presença dos elementos La e Ce. A estrutura das partículas metálicas recuperadas pôde ser observada por microscopia eletrônica de varredura, o que possibilitou a ampliação de sua imagem em 10 mil vezes (Figura 1).
Para extrair os outros metais de interesse, os pesquisadores realizaram novas sequências de adição de ácidos, bases e outros reagentes em concentrações específicas, o que levou à formação de novos sólidos dentro do líquido. Esses sólidos foram então separados do líquido por centrifugação (rotação em alta velocidade) e secos.
Níquel, cobalto e ferro não foram obtidos como metais puros, mas sim na forma de hidróxidos, como hidróxido de níquel (Ni(OH)2), hidróxido de cobalto (Co(OH)2) e hidróxido de ferro (Fe(OH)3).
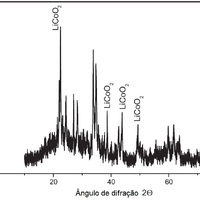
Em uma última etapa do processo, o Ni(OH)2 foi misturado com um composto de lítio (Li), gerando o cobiçado óxido de lítio-cobalto (LiCoCO2), material usado na fabricação de eletrodos positivos em baterias de íon-lítio. Como nas etapas anteriores, a composição dos materiais obtidos foi confirmada com o uso de espectroscopia de raios X (Figura 2).
A Figura 2 representa um difratograma de raios X que confirma a presença de LiCoCO2 na amostra. Os raios X são lançados em ângulos diferentes em relação às partículas sólidas e são refratados em direção a um detector. O detector registra a intensidade da difração dos raios X em cada ângulo. Os ângulos que geram picos fornecem informação sobre a estrutura do material. O padrão de picos observado é consistente com o que seria esperado em um cristal contendo óxido de lítio-cobalto, confirmando sua presença no material.
Em seguida, os cientistas reuniram os eletrodos negativos (MH) das baterias, dissolveram-nos em ácido, filtraram a solução líquida resultante e adicionaram a ela soda cáustica (hidróxido de sódio). Isso fez com que os metais terras raras lantânio (La) e cério (Ce), originalmente presentes na liga metálica, se agregassem e precipitassem, formando um novo sólido. Esse sólido foi separado do resto da solução aquosa e suas características moleculares foram avaliadas com técnicas de espectroscopia.
A composição química do sólido obtido foi determinada com difração de raios X, que confirmou a presença dos elementos La e Ce. A estrutura das partículas metálicas recuperadas pôde ser observada por microscopia eletrônica de varredura, o que possibilitou a ampliação de sua imagem em 10 mil vezes (Figura 1).
Para extrair os outros metais de interesse, os pesquisadores realizaram novas sequências de adição de ácidos, bases e outros reagentes em concentrações específicas, o que levou à formação de novos sólidos dentro do líquido. Esses sólidos foram então separados do líquido por centrifugação (rotação em alta velocidade) e secos.
Níquel, cobalto e ferro não foram obtidos como metais puros, mas sim na forma de hidróxidos, como hidróxido de níquel (Ni(OH)2), hidróxido de cobalto (Co(OH)2) e hidróxido de ferro (Fe(OH)3).
Em uma última etapa do processo, o Ni(OH)2 foi misturado com um composto de lítio (Li), gerando o cobiçado óxido de lítio-cobalto (LiCoCO2), material usado na fabricação de eletrodos positivos em baterias de íon-lítio. Como nas etapas anteriores, a composição dos materiais obtidos foi confirmada com o uso de espectroscopia de raios X (Figura 2).
A Figura 2 representa um difratograma de raios X que confirma a presença de LiCoCO2 na amostra. Os raios X são lançados em ângulos diferentes em relação às partículas sólidas e são refratados em direção a um detector. O detector registra a intensidade da difração dos raios X em cada ângulo. Os ângulos que geram picos fornecem informação sobre a estrutura do material. O padrão de picos observado é consistente com o que seria esperado em um cristal contendo óxido de lítio-cobalto, confirmando sua presença no material.
Os compostos foram obtidos a partir de baterias usadas de telefones celulares. A figura mostra que os compostos se organizam em estrutura hexagonal, formando partículas com cerca de 1µm de comprimento (µm: micrômetro = milionésimo de metro). A figura foi obtida com um microscópio eletrônico de varredura, que ampliou em 10 mil vezes a aparência do objeto natural.
O LiCoCO2 é usado na produção de modernas baterias de íon-lítio. O gráfico, um difratograma de raios X, mostra o comportamento de feixes de raios X lançados sobre amostras das partículas sólidas obtidas na reação química. Os ângulos que geram picos na figura fornecem informação sobre a estrutura do material. O padrão de picos é consistente com o que seria esperado em um cristal contendo óxido de lítio-cobalto, confirmando sua presença no material.
Qual a importância da pesquisa?
A substituição de baterias de Ni-MH pelas baterias mais eficientes de íon-lítio gerou um problema: o que fazer com as baterias usadas? Enterrá-las ou queimá-las gera poluição, além de custar caro. Uma possibilidade seria recuperar parte dos materiais utilizados na fabricação dessas baterias.
Baterias de Ni-MH, em particular, são produzidas com metais altamente valorizados pela indústria. Entram na sua composição ferro (usado na produção de aço), níquel (usado em revestimentos de carros, motos e bicicletas), cobalto (usado na fabricação de ligas magnéticas ou eletrodos de baterias) e metais terras raras (usados na fabricação de ímãs permanentes e baterias de carros elétricos).
A pesquisa realizada no Espírito Santo é importante, pois apresenta um método de extração desses materiais. Em particular, o método descrito permite obter lantânio, metal atualmente bastante usado na fabricação de baterias de carros elétricos, e óxido de lítio-cobalto, usado na produção de eletrodos de baterias de íon-lítio.
Saiba mais: Como as baterias de Ni-MH geram eletricidade?
As baterias de níquel-hidreto metálico (Ni-MH) são formadas por vários compostos químicos, incluindo níquel (Ni), lantânio (La) e cobalto (Co). Além disso, as ligas metálicas (MH) das baterias de Ni-MH contêm hidrogênio (H). É esse elemento, com apenas um elétron em sua composição, que dá origem à corrente elétrica da bateria.
Baterias em geral possuem duas partes essenciais: os eletrodos positivos e negativos. A movimentação de elétrons entre esses dois eletrodos é que gera uma corrente elétrica. Essa corrente elétrica fornece a energia necessária para o funcionamento de aparelhos celulares e laptops.
Durante a descarga de uma bateria, ocorre oxidação nos eletrodos negativos. Na reação de oxidação, o hidrogênio acoplado à liga metálica (MH) desprende-se dela e se une a íons hidróxido (OH-) presentes no interior da bateria, gerando água (H2O) e um elétron. Esse elétron, oriundo do átomo de hidrogênio da liga metálica, é transferido do eletrodo negativo para o eletrodo positivo.
No eletrodo positivo, ocorre a redução, reação que transforma o óxi-hidróxido de níquel (NiOOH) presente nesse eletrodo em hidróxido de níquel (Ni(OH)2), uma substância que possui um elétron a mais. Assim, elétrons são transferidos de um eletrodo para o outro. É essa reação de oxirredução que gera corrente elétrica na bateria.
Quando a bateria é recarregada, o processo se inverte, ocorrendo a oxidação do Ni(OH)2, que volta a ser NiOOH, e a redução da liga metálica (M), que ganha H e volta a ser MH. Esse processo de recarga é movido pela energia fornecida por um carregador. Nesse caso, a energia elétrica não vem de dentro da própria bateria, mas é fornecida por uma fonte externa (uma tomada ligada à rede elétrica da casa, por exemplo).
Baterias de Ni-MH, em particular, são produzidas com metais altamente valorizados pela indústria. Entram na sua composição ferro (usado na produção de aço), níquel (usado em revestimentos de carros, motos e bicicletas), cobalto (usado na fabricação de ligas magnéticas ou eletrodos de baterias) e metais terras raras (usados na fabricação de ímãs permanentes e baterias de carros elétricos).
A pesquisa realizada no Espírito Santo é importante, pois apresenta um método de extração desses materiais. Em particular, o método descrito permite obter lantânio, metal atualmente bastante usado na fabricação de baterias de carros elétricos, e óxido de lítio-cobalto, usado na produção de eletrodos de baterias de íon-lítio.
Saiba mais: Como as baterias de Ni-MH geram eletricidade?
As baterias de níquel-hidreto metálico (Ni-MH) são formadas por vários compostos químicos, incluindo níquel (Ni), lantânio (La) e cobalto (Co). Além disso, as ligas metálicas (MH) das baterias de Ni-MH contêm hidrogênio (H). É esse elemento, com apenas um elétron em sua composição, que dá origem à corrente elétrica da bateria.
Baterias em geral possuem duas partes essenciais: os eletrodos positivos e negativos. A movimentação de elétrons entre esses dois eletrodos é que gera uma corrente elétrica. Essa corrente elétrica fornece a energia necessária para o funcionamento de aparelhos celulares e laptops.
Durante a descarga de uma bateria, ocorre oxidação nos eletrodos negativos. Na reação de oxidação, o hidrogênio acoplado à liga metálica (MH) desprende-se dela e se une a íons hidróxido (OH-) presentes no interior da bateria, gerando água (H2O) e um elétron. Esse elétron, oriundo do átomo de hidrogênio da liga metálica, é transferido do eletrodo negativo para o eletrodo positivo.
No eletrodo positivo, ocorre a redução, reação que transforma o óxi-hidróxido de níquel (NiOOH) presente nesse eletrodo em hidróxido de níquel (Ni(OH)2), uma substância que possui um elétron a mais. Assim, elétrons são transferidos de um eletrodo para o outro. É essa reação de oxirredução que gera corrente elétrica na bateria.
Quando a bateria é recarregada, o processo se inverte, ocorrendo a oxidação do Ni(OH)2, que volta a ser NiOOH, e a redução da liga metálica (M), que ganha H e volta a ser MH. Esse processo de recarga é movido pela energia fornecida por um carregador. Nesse caso, a energia elétrica não vem de dentro da própria bateria, mas é fornecida por uma fonte externa (uma tomada ligada à rede elétrica da casa, por exemplo).
Área do Conhecimento
Ciências Exatas e da Terra
Palavras-chave – Entre 3 a 5 palavras
Português
hidrometalurgia
Português
baterias elétricas
Português
reciclagem de resíduos urbanos
ODS
ODS 9: Indústria, Inovação e Infraestrutura
ODS 12: Consumo e Produção Responsáveis.
Referência da Pesquisa Original
Dos Santos. Vinicius Emmanuel de Oliveira, Celante. Vinicius Guilherme, Lelis. Maria de Fátima Fontes. De Freitas. Marcos Benedito José Geraldo, Método hidrometalúrgico para reciclagem de metais terras raras, cobalto, níquel, ferro e manganês de eletrodos negativos de baterias exauridas de Ni-MH de telefone celular. Scielo, Vol. 37, P.1-5, publicado em 10/2013. Disponível em:https://www.scielo.br/j/qn/a/HzWtjVwcBrrW6Z9R4Fm3SXD/?format=pdf&lang=pt. Acesso em : 26 de julho de 2022.
Link da pesquisa original
Data da publicação do texto de divulgação
March 7, 2014